

研究領域
本實驗室研究涵蓋生物化學工程與生醫工程,以基因工程技術為核心,兼顧前瞻學術研究與產學發展,主要研究領域如下所示:
1.
基因治療用於再生醫學及癌症治療
開發桿狀病毒基因載體技術:
桿狀病毒是一種昆蟲病毒,一般被用於感染昆蟲細胞生產蛋白質,應用於基因治療是近十餘年來新發展的領域。本實驗室是此領域的開創者之一,也在此領域居領先地位。本實驗室率先以生物工程觀點切入,研發桿狀病毒之定量、生產、純化方法,最適化桿狀病毒的基因傳遞條件,並進而找出影響桿狀病毒基因傳遞效率的重要因素。這些研究方向包含了基因治療應用面的上、中、下游,對桿狀病毒於基因治療的應用有極大的助益。
桿狀病毒作為基因載體有多種優點,但唯一的缺點是病毒DNA不會複製,在細胞內很快就會被分解,使得基因表現時間很短暫(小於7天),因而限制了桿狀病毒在某些需要長期表現基因的症狀(如癌症)之應用。為克服此缺點,個人開發了新型的長效型桿狀病毒,使病毒所攜帶的外來基因可以切離病毒DNA,再以游離基因的形式存在,不會嵌入細胞染色體,也不會造成細胞癌化或影響分化,但又可在細胞內長期存在,因此可大幅延長基因表現期,並拓展桿狀病毒載體的應用。
為進一步拓展此系統在幹細胞的應用性及降低毒性,本實驗室又新開發二種桿狀病毒系統,並比較這三種桿狀病毒系統在各種哺乳動物細胞內延長基因表現的效果,毒性,基因重組效率,並在脂肪幹細胞內證實以此桿狀病毒系統加速誘導細胞往硬骨路徑分化的效果。
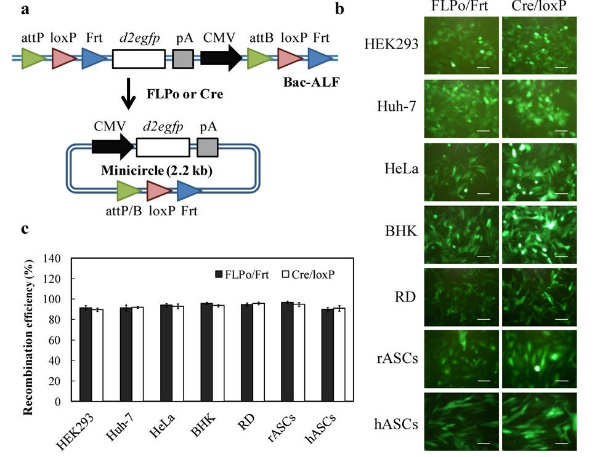
Fig.
1.
發展FLPo/Frt及Cre/loxP系統為基礎之混成桿狀病毒,能有效延長蛋白表現之時效。(a)
FLPo與Cre表現載體之建構簡圖,在細胞表達FLPo或Cre後,能使DNA進行環化,形成Episome。
(b-c)
螢光顯微鏡之結果顯示,此系統能在不同種類細胞內進行轉導,且都可延長蛋白表現時效。(c)流式細胞儀分析量化之結果。(Nature
Protocols 2014, 9:1882; Nucleic Acids Research, 2013, 14:e139)
以
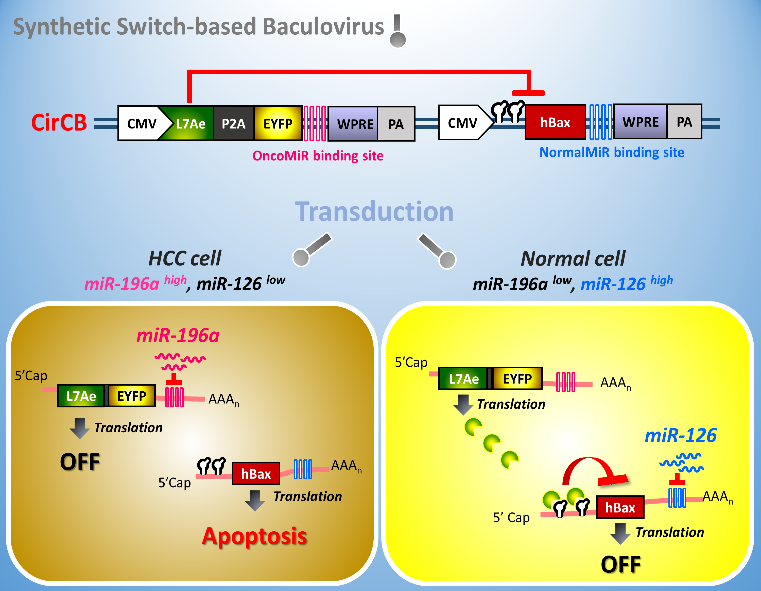
L7Ae/K-turn
抑制模組及
miRNA結合位建構迴路控制反應匣(synthetic
switch),並安裝至桿狀病毒載體中。當此病毒進入細胞後能夠感應癌細胞及正常內所表達微小
RNA
的差異性,進而調控外來基因的開關,促使細胞凋亡因子(hBax
)只會在肝癌細胞表現並產生毒殺力,但不會對正常細胞產生傷害。Nucleic
Acids Research, 2018, 14:e139.
(IF 16.971)
結合基因治療於再生醫學:
大範圍骨缺陷的修復對骨科及整形外科醫師來說是重大挑戰。在骨組織工程中,骨髓間葉幹細胞(BMSC)與脂肪間葉幹細胞(ASC)與相當受歡迎的細胞來源。但單獨使用間葉幹細胞仍不容易修復大範圍骨缺陷。個人應用所發展的新型長效表現型桿狀病毒載體轉導BMSC及ASC表現適當生長因子,可以刺激細胞的分化以及組織修復,在植入細胞後,可在8週內完全修復兔子以及大動物(迷你豬)的大範圍骨缺損,使此技術更貼近臨床應用。
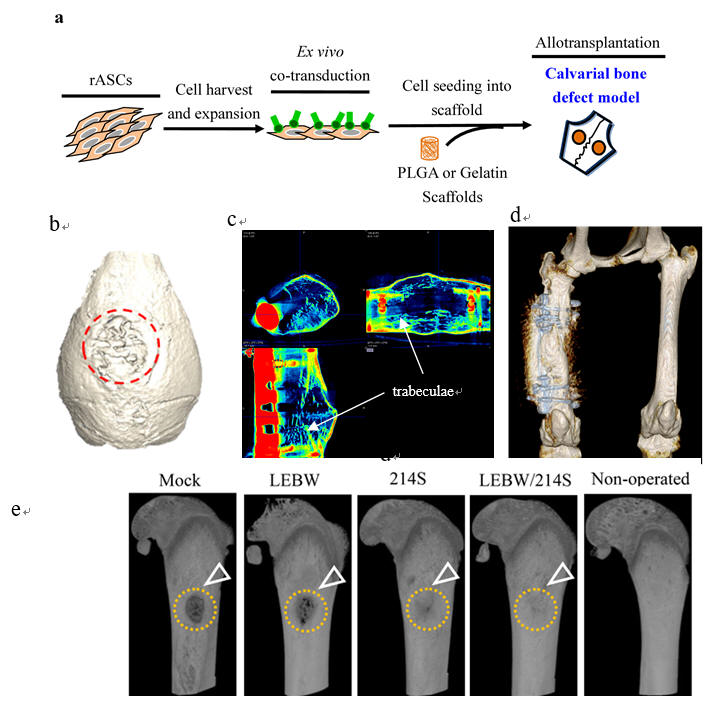
Fig.
2.
利用基因改造之桿狀病毒,誘導脂肪幹細胞分化並應用於修復硬骨缺陷.
(a)利用桿狀病毒轉導分化相關基因(如BMP-2
and microRNA),並應用於兔子硬骨組織修復,病毒轉導後的細胞移植至硬骨缺陷處,以促進硬骨修復。(b-e)
經桿狀病毒轉導後之細胞,能有效增加硬骨修復之速度
(Biomaterials, 2017, 124:1; Biomaterials, 2016, 74:155; Biomaterials, 2015,
50:98).
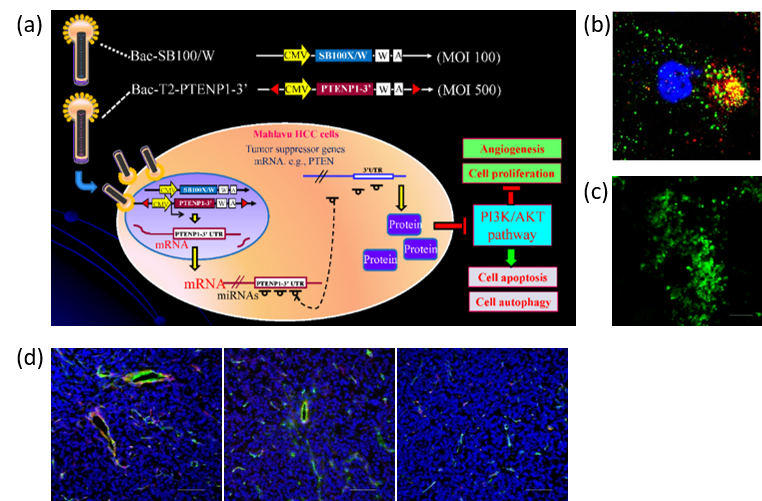
Fig.
3.
腸病毒71型在臺灣對兒童造成嚴重的健康威脅。個人模擬腸病毒的複製過程,首創應用桿狀病毒/昆蟲細胞表現系統共同表現腸病毒71型的P1結構多蛋白與3CD水解酶,使3CD切割P1成個別結構蛋白質,讓蛋白質自發性組裝形成類似病毒的奈米顆粒(virus-like
particle, VLP)。本實驗室首次證實此VLP在動物中能誘發具中和病毒能力的抗體及細胞性免疫反應,並提供交叉保護。此論文在2008年發表後,受到各界廣泛注意及媒體大幅報導,不但WOS引用次數已達170次,且吸引葛蘭素(GSK),默沙東(Merck)及輝瑞(Pfizer)等世界級藥廠與個人洽談合作,以及衛生署專案經費補助2900萬元。這是全世界首次應用基因工程製備的腸病毒71型疫苗,對兒童健康有重大幫助,也成為各國學者及研究機構在發展腸病毒VLP疫苗時的標準方法。
此外,本實驗室也在2017年便開始RNA疫苗研究。與現在莫德納技術相比,我們開發self-amplifying RNA (SaRNA)技術,使RNA可在細胞內複製一段時間,進而可增強並加速免疫反應的產生。PRRSV (PRRS病毒)會造成豬藍耳病,造成全球養豬產業嚴重經濟損失,但現今商業化疫苗效果仍然不佳。我們應用SaRNA技術成功開發豬的新型SaRNA疫苗,用於PRRS抗原表現,並已在小鼠實驗模型中證實,可以比商業化疫苗產生更強以及更快的中和抗體,因此可望成為新一代的PRRS疫苗。
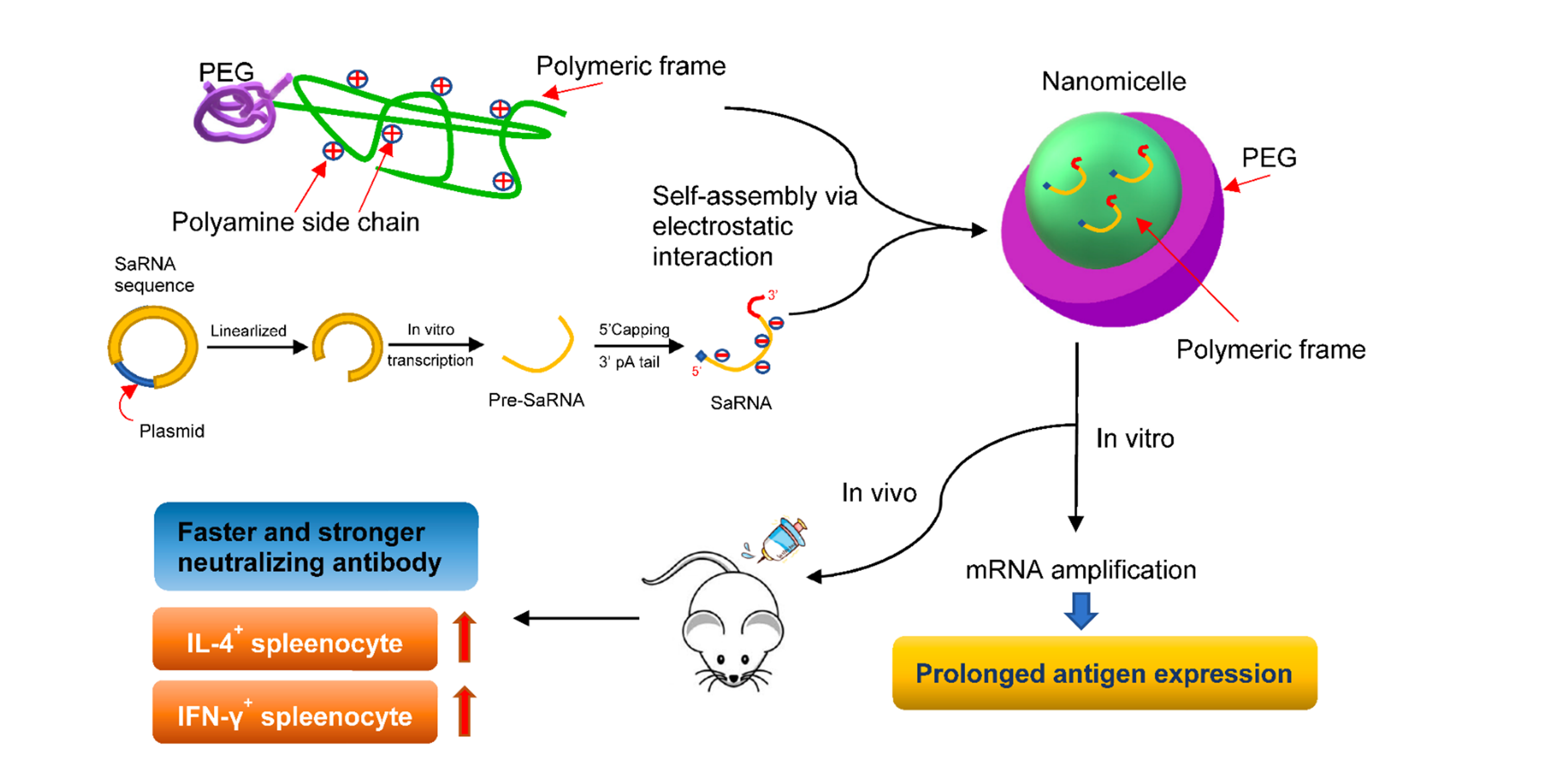
Fig.
5.
Self-amplifying mRNA (SaRNA)疫苗開發。我們開發SaRNA,使mRNA可在細胞內複製一段時間,進而可增強並加速免疫反應的產生,並已在小鼠實驗模型中證實可以比現有的疫苗產生更強以及更快的中和抗體,因此可望成為新一代的豬之新型mRNA疫苗。本研究應邀發表於藥物輸送之頂尖期刊
(Journal of Controlled Release. 338: 694-704. IF
9.776)
4.開發CRISPR與合成生物學工具
CRISPR應用Cas9
(或其他新的endonuclease)及guide
RNA設計,切割並編輯DNA。但是過長的Cas9蛋白表現會造成嚴重的脫靶效應(off-target
effects)及副作用。我們以合成生物學原理,發展人工合成迴路(synthetic
switch)搭配副回饋調控Cas9蛋白系統,由迴路關閉DNA及RNA,同時抑制Cas9的轉錄與轉譯,減低CRISPR系統在基因編輯時所產生脫靶效應。本研究能大幅減少CRISPR系統應用在基因編輯的副作用。
雖然CRISPRa與CRISPRi可分別活化與抑制基因表現,但目前仍難以同時雙向調控基因表現。個人開發出CRISPR-AI系統,可在哺乳動物細胞內同時活化一種基因,並抑制另一基因。個人將此CRISPR-AI系統送入幹細胞後,可同時活化(Activation)與抑制(Inhibition)兩種分化路徑的重要調控基因,促進幹細胞往軟骨分化,並且抑制細胞往脂肪分化,因此大幅提升幹細胞分化成軟骨細胞的效率。將此細胞送入頭蓋骨組織缺陷,可以大幅提升頭蓋骨的修復效率。此研究領先全世界,首創開發CRISPR-AI雙向基因調控系統並用於組織再生,並獲多個媒體(TVBS,自由時報、蘋果日報、聯合報、中國時報、中央社、科技新報、生策會電子報)大幅報導。
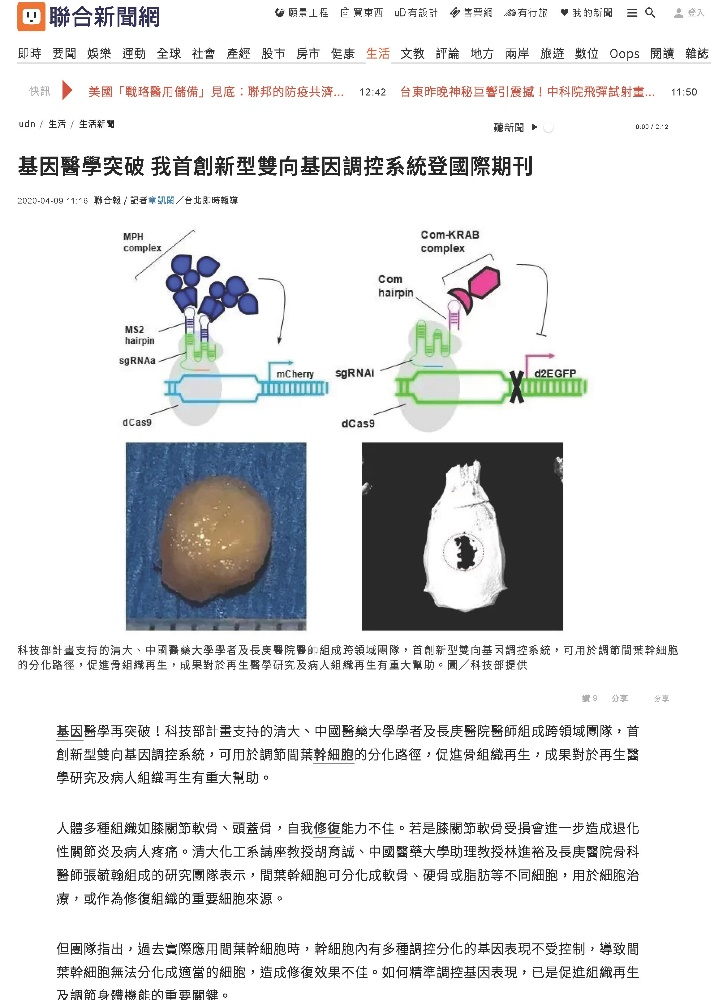
我們在近期也發展出CRISPR-BiD系統進行雙向(Bi-Directional)基因調控。本系統同時應用CRISPR調控組蛋白的乙醯化(acetylation)及轉錄活化(transcription activation)刺激一組基因的活化,並同時結合CRISPRi 促進基因的甲基化以抑制另一組基因的表現,以達到雙向基因調控的目的。我們應用CRISPR-BiD系統刺激幹細胞分化,並且在植入頭蓋骨缺陷後,大幅度刺激頭蓋骨修復。
微生物代謝工程與生質化學品生產:
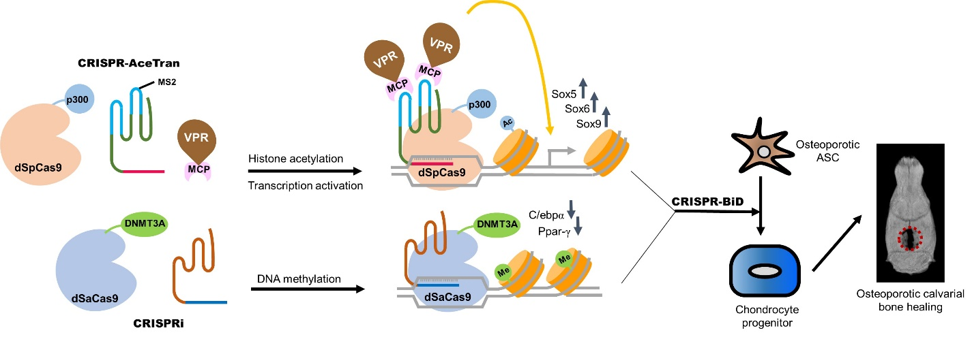
CRISPR-BiD雙向基因調控系統。Molecular Therapy (2021), https://doi.org/10.1016/j.ymthe.2021.08.024. (IF 11.454).
本實驗室與國內第二大的石化集團長春集團合作,發展 CRISPR技術進行微生物的基因編輯,以調控微生物的代謝路徑,並生產長春集團需要的生質化學品。大腸桿菌是最常使用在生質化學品的細菌,但是傳統方法只能嵌入小片段基因。我們首先應用CRISPR提升將外源基因嵌入染色體的效率,並優化步驟,成功將高達7 kb的DNA嵌入染色體。此技術克服了傳統方法的限制,也發表在生物工程領域的重要期刊Biotechnol. Bioeng. (High Cite paper)。藍綠菌是可以行光合作用,以CO2為碳源的細菌。我們開發出基因編輯藍綠菌的CRISPR技術,此方法大幅縮短基因改造藍綠菌的時間,並可將CO2捕捉轉換成生質化學品,達到綠能減碳的目的,因此發表於代謝工程領域最好的期刊Metabolic Engineering (IF 9.783)。
我們也發展CRISPRi抑制藍綠菌內的基因表現,進而重佈(rewire)代謝路徑,以增加琥珀酸產量。我們並結合CRISPR與CRISPRi,同時進行基因編輯與抑制基因表現,以調控代謝路徑,並生產1,4 butanediol。我們在最近也開發出一種結合轉位子及CRISPR的基因編輯技術(稱為iCAST),可以有效快速的將大片段基因嵌入到大腸桿菌染色體內,並且降低細胞內的有機酸副產物的生成。應用這些技術為基礎,我們成功基因編輯許多難以用傳統方法基因改造的微生物,如藍綠菌、戀臭假單胞菌與維斯假絲酵母菌,更發展出創新的iCAST基因編輯技術改造大腸桿菌。這些技術及菌株已成功用於生產琥珀酸、1,4-丁二醇、2,3-丁二醇、2,5-呋喃二甲酸、12-胺基月桂酸等重要化學原料,已發表11篇重要論文至國際重要期刊,獲得9件台灣、美國、中國專利,以及多項專利申請中。
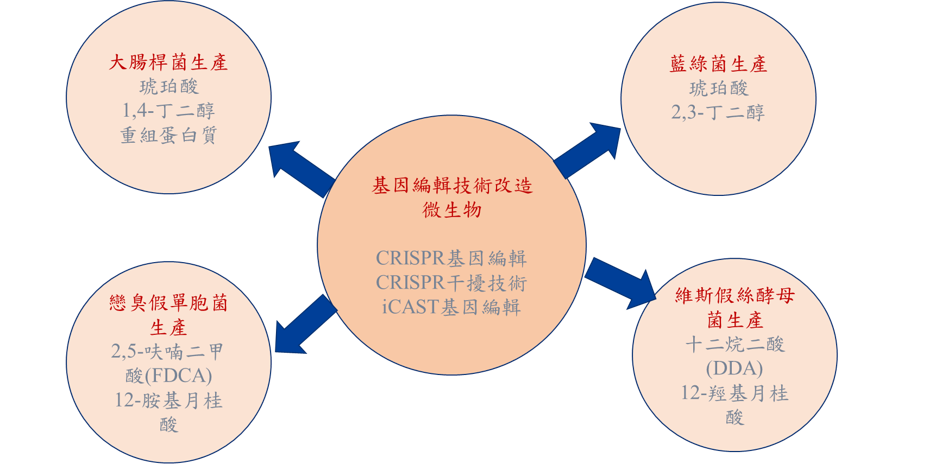
發展CRISPR/CRISPRi技術調控微生物代謝路徑,並生產生質化學品。